Rozwój materiałów kompozytowych istotnie zmienił oblicze współczesnej ortopedii, wpływając zarówno na projektowanie implantów, jak i na metody leczenia urazów oraz chorób zwyrodnieniowych układu ruchu. Postęp w dziedzinie inżynierii materiałowej pozwolił na opracowanie wyrobów łączących w sobie cechy kilku składników – metali, polimerów, ceramik i włókien – tak, aby jak najlepiej odwzorować właściwości naturalnej tkanki kostnej i chrzęstnej. Dzięki temu współczesny przemysł medyczny może oferować pacjentom implanty bardziej biokompatybilne, lżejsze, odporniejsze na zmęczenie i lepiej integrujące się z organizmem. Wraz z tym rozwojem pojawiają się jednak nowe wyzwania: konieczność zapewnienia długoterminowego bezpieczeństwa, zgodności z rygorystycznymi normami regulacyjnymi, a także dostosowania technologii produkcji do specyficznych wymagań chirurgów i pacjentów.
Podstawy materiałoznawstwa kompozytów stosowanych w ortopedii
Materiał kompozytowy to układ co najmniej dwóch faz o odmiennych właściwościach, połączonych w sposób trwały i zaprojektowanych tak, aby uzyskać nową kombinację cech mechanicznych, fizycznych i biologicznych. W ortopedii celem tworzenia kompozytów jest osiągnięcie takiego zestawu parametrów, jak sztywność, wytrzymałość na zginanie, odporność zmęczeniowa, biozgodność czy zdolność do osteointegracji, który byłby możliwie najbardziej zbliżony do właściwości kości lub chrząstki, przy jednoczesnym spełnieniu wymogów sterylizacji, obróbki chirurgicznej i długotrwałego użytkowania w organizmie.
Naturalna kość sama w sobie jest przykładem kompozytu biologicznego. Składa się z organicznej matrycy kolagenowej i nieorganicznego minerału – hydroksyapatytu. Dzięki temu posiada unikalne połączenie elastyczności i twardości. Tworząc kompozyty inżynierskie do zastosowań ortopedycznych, badacze starają się naśladować tę naturalną strukturę, wykorzystując polimery, ceramikę i włókna w różnych proporcjach oraz konfiguracjach. W efekcie powstają rozwiązania, które coraz lepiej wpasowują się w środowisko biologiczne, a jednocześnie spełniają rygorystyczne kryteria mechaniczne wymagane dla elementów przenoszących obciążenia.
Dla przemysłu medycznego kluczowe jest nie tylko opracowanie optymalnego składu kompozytu, ale także zapewnienie powtarzalności produkcji, stabilności parametrów oraz przewidywalnego zachowania materiału w czasie. Z tego powodu projektowanie kompozytów ortopedycznych wymaga ścisłej współpracy inżynierów materiałowych, biologów, lekarzy klinicystów oraz specjalistów ds. regulacji i jakości. Każda zmiana w składzie, rodzaju włókien czy parametrach procesu wytwarzania musi być odpowiednio zwalidowana, aby zagwarantować bezpieczeństwo i skuteczność kliniczną wyrobu.
Rodzaje materiałów kompozytowych i ich właściwości istotne w ortopedii
Kompozyty wykorzystywane w ortopedii można podzielić na kilka głównych grup w zależności od rodzaju matrycy i fazy zbrojącej. Najczęściej spotykane są kompozyty polimerowo-włókniste, kompozyty ceramizowane oraz struktury warstwowe łączące metal z polimerem lub ceramiką. Każda z tych grup ma określone zalety i ograniczenia, które wpływają na dobór materiału do konkretnego typu implantu lub narzędzia chirurgicznego.
Kompozyty polimerowo-włókniste
Kompozyty z matrycą polimerową i zbrojeniem włóknistym stanowią jedną z najważniejszych kategorii materiałów dla nowoczesnej ortopedii. Matryca polimerowa – najczęściej na bazie polietereteroketonu (PEEK), poli(kwasu mlekowego) (PLA), poliglikolidu (PGA) lub ich kopolimerów – zapewnia ciągłość struktury i odpowiednią plastyczność, natomiast włókna (szklane, węglowe, czasem biodegradowalne) nadają całości wysoką wytrzymałość mechaniczną.
PEEK, wzmocniony włóknem węglowym, jest przykładem kompozytu o właściwościach szczególnie atrakcyjnych dla przemysłu medycznego. Charakteryzuje się on modułem sprężystości zbliżonym do kości korowej, wysoką odpornością zmęczeniową oraz biostabilnością. Dzięki temu redukuje zjawisko stresowego ekranowania (stress shielding), występujące w przypadku bardzo sztywnych implantów metalowych, takich jak tytan czy stale chromowo-kobaltowe. Zjawisko to polega na tym, że zbyt sztywny implant przejmuje większość obciążenia, co prowadzi do stopniowej resorpcji otaczającej go kości. Kompozyty polimerowo-włókniste pozwalają lepiej rozkładać siły, zachowując fizjologiczną stymulację tkanki kostnej.
Ważną cechą wielu kompozytów polimerowych jest ich rentgenowska przezierność lub możliwość modyfikacji pod kątem uwidocznienia w badaniach obrazowych. Dla chirurgów ortopedów stanowi to istotny atut, ponieważ pozwala na dokładną ocenę zrostu kostnego, przebudowy tkanki i położenia elementów stabilizujących w czasie kontroli pooperacyjnych. Dodatek markerów radiologicznych, takich jak siarczan baru czy tlenek cyrkonu, umożliwia jednoczesne zachowanie korzystnych właściwości mechanicznych i poprawę widoczności kompozytowych implantów.
Kompozyty bioresorbowalne i bioaktywne
Oddzielną, niezwykle dynamicznie rozwijającą się grupą są kompozyty bioresorbowalne, zaprojektowane tak, aby ulegać stopniowemu rozkładowi w organizmie, zastępowane nowo tworzoną tkanką kostną. Najczęściej matrycę stanowią polimery alifatyczne, takie jak PLA, PGA czy ich kopolimer PLGA, natomiast fazę ceramiczną – bioaktywne cząstki fosforanów wapnia, w tym hydroksyapatytu lub β-trójfosforanu wapnia (β-TCP).
Takie kompozyty łączą mechaniczne wsparcie w początkowym okresie gojenia z możliwością biologicznej integracji i ostatecznego usunięcia materiału z organizmu bez konieczności wykonywania kolejnej operacji w celu wyjęcia implantu. Znacząco zmniejsza to obciążenie pacjenta i systemu ochrony zdrowia. Odpowiednio dobrana kinetyka degradacji jest jednak wyzwaniem inżynierskim: materiał nie może rozkładać się zbyt szybko, aby nie utracić stabilizującej funkcji przed ukończeniem procesu zrostu, ani zbyt wolno, by nie wywoływać przewlekłej reakcji zapalnej.
Kompozyty bioaktywne wykraczają poza bierną rolę wypełniacza czy stabilizatora. Dzięki modyfikacji składu i struktury powierzchniowej mogą stymulować osteogenezę, przyspieszać integrację implantu z kością lub modulować reakcję zapalną. Wprowadzenie jonów takich jak stront, magnez czy krzem do fazy ceramicznej może sprzyjać aktywności osteoblastów, natomiast kontrolowane uwalnianie czynników wzrostu z matrycy polimerowej stworzyło podstawy dla rozwoju kompozytowych nośników leków, integrujących funkcję mechanicznego wsparcia z lokalną terapią farmakologiczną.
Kompozyty metal-polimer i metal-ceramika
W zastosowaniach, w których wymagane jest bardzo wysokie przenoszenie obciążeń, wciąż dominują metale – głównie stopy tytanu oraz stale stopowe. Jednocześnie rośnie zapotrzebowanie na modyfikację ich powierzchni lub struktury w taki sposób, aby poprawić interakcję z tkankami. Na tym tle rozwijają się kompozyty metal-polimer oraz metal-ceramika, często w formie struktur warstwowych, powłok lub wypełnień porowatych.
Przykładem mogą być implanty tytanowe pokryte warstwą bioaktywnej ceramiki, takiej jak hydroksyapatyt, nanoszone metodą natrysku plazmowego, osadzania elektrochemicznego lub technik sol-gel. Warstwa ta pełni funkcję kompozytowego interfejsu, który poprawia osteointegrację i skraca czas stabilizacji pierwotnej implantu. Z kolei warstwy polimerowe wzmocnione mikro- lub nanocząstkami ceramiki mogą nadawać powierzchni właściwości przeciwzużyciowe oraz regulować tarcie w endoprotezach stawów.
W przemyśle medycznym coraz częściej wykorzystuje się także koncepcję gradientu materiałowego, w którym skład i właściwości kompozytu zmieniają się stopniowo od rdzenia metalowego do powierzchni kontaktującej się z tkanką miękką lub kostną. Pozwala to zredukować koncentracje naprężeń, poprawić przyczepność warstw oraz zapobiec przedwczesnym uszkodzeniom, szczególnie w długotrwale obciążanych implantach, takich jak trzony endoprotez biodrowych czy śrubokręty kostne.
Zastosowania kompozytów w implantologii i inżynierii układu ruchu
W ortopedii przemysł medyczny wykorzystuje kompozyty w szeregu wyrobów: od małych śrub i płytek, przez kręgosłupowe systemy stabilizujące, aż po kompleksowe endoprotezy dużych stawów. Odpowiedni dobór materiału wynika z rodzaju obciążenia, miejsca implantacji, wieku i aktywności pacjenta, a także przewidywanego czasu pozostawania implantu w organizmie.
Stabilizacja kostna: śruby, płytki, gwoździe
Tradycyjnie złamania kości stabilizowano przy pomocy metalowych śrub i płytek wykonanych z tytanu lub stali nierdzewnej. Wprowadzenie kompozytów bioresorbowalnych oraz polimerowo-włóknistych otworzyło nowe możliwości postępowania w ortopedii i traumatologii. W tym obszarze kluczowe okazały się materiały o kontrolowanej degradacji, umożliwiające rezygnację z wtórnych zabiegów usuwania implantów.
Śruby wykonane z kompozytów PLA/PGA z domieszką fosforanów wapnia stosuje się powszechnie w chirurgii urazowej oraz w rekonstrukcjach więzadeł, zwłaszcza w obrębie stawu kolanowego i skokowego. Ich wytrzymałość jest wystarczająca, by zapewnić stabilizację w okresie, gdy powstaje zbliznowaciała tkanka łączna lub rozpoczyna się proces mineralizacji kości. W miarę jak implant ulega rozkładowi, obciążenia stopniowo przechodzą na odbudowaną tkankę, co sprzyja jej fizjologicznej przebudowie.
Płytki kompozytowe z PEEK wzmocnionym włóknem węglowym konkurują z płytkami tytanowymi w przypadkach wymagających długotrwałej i wysoce obciążonej stabilizacji, na przykład w złamaniach kości długich u pacjentów aktywnych fizycznie. Niższy moduł sprężystości, zbliżony do kości, prowadzi do korzystniejszego rozkładu naprężeń, co zmniejsza ryzyko zaników kostnych w sąsiedztwie implantu. Dodatkowym atutem jest brak artefaktów w rezonansie magnetycznym i ograniczone zaburzenia w tomografii komputerowej, ułatwiające diagnostykę pooperacyjną.
Endoprotezy stawów i panewki kompozytowe
Obszarem, w którym kompozyty wniosły szczególnie istotną wartość, są endoprotezy dużych stawów – biodrowego, kolanowego czy barkowego. Tradycyjny układ metal-metal lub metal-polietylen, mimo wieloletniego doświadczenia, boryka się z problemami ścierania, generowania cząstek zużycia oraz konsekwencji biologicznych w postaci reakcji zapalnych i osteolizy. Kompozyty polimerowo-ceramiczne oraz modyfikowane powłoki kompozytowe pozwalają ograniczyć te zjawiska.
W przypadku endoprotez biodrowych wprowadzono panewki wykonane z modyfikowanego polietylenu o wysokiej odporności na ścieranie, nasyconego dodatkami antyoksydacyjnymi oraz cząstkami ceramicznymi. Choć same w sobie stanowią kompozyty o stosunkowo prostym składzie, ich zachowanie w kontakcie z główką ceramiczną lub metalową znacząco różni się od klasycznego polietylenu, zapewniając mniejszą liczbę mikrocząstek zużycia w przestrzeni stawowej. Dla przemysłu medycznego oznacza to możliwość oferowania rozwiązań o wydłużonej żywotności, co jest szczególnie ważne w przypadku młodszych i aktywniejszych pacjentów, u których oczekuje się wieloletniego, a nawet dożywotniego utrzymania implantu.
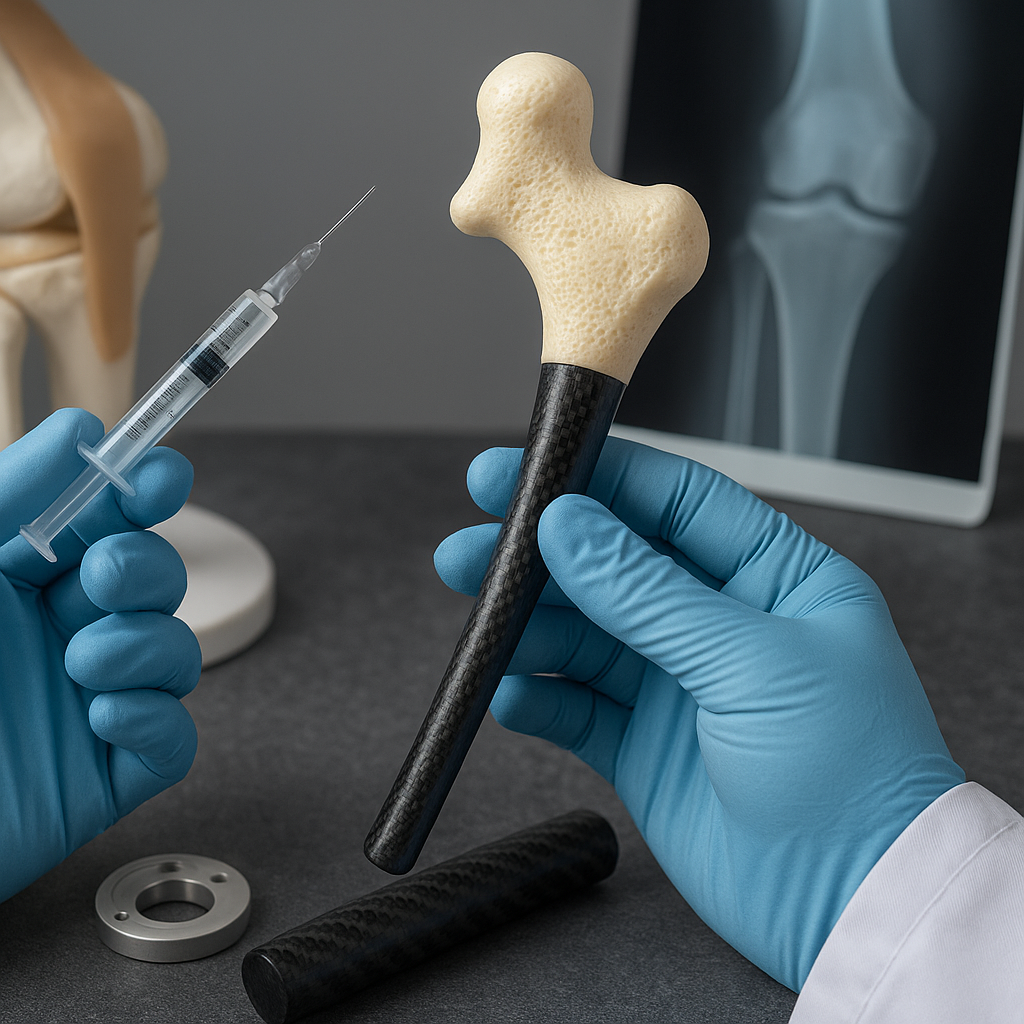
Innym kierunkiem są kompozytowe trzony endoprotez, w których rdzeń metalowy (np. tytanowy) otoczony jest warstwą kompozytu polimerowo-włóknistego z gradientem sztywności. Pozwala to dopasować właściwości mechaniczne w różnych strefach kontaktu z kością, minimalizując lokalne przeciążenia. Warstwa zewnętrzna może dodatkowo zawierać cząstki bioaktywne, sprzyjające szybszemu zespoleniu z kością, co skraca okres rekonwalescencji i zmniejsza ryzyko obluzowania aseptycznego.
Kompozyty w chirurgii kręgosłupa
W chirurgii kręgosłupa znaczącą rolę odegrały implanty korpowe, klatki międzytrzonowe i systemy stabilizacji wykonane z kompozytów PEEK wzmocnionych włóknami. Ich wprowadzenie zmieniło podejście do leczenia dyskopatii, złamań trzonów kręgów, deformacji oraz niestabilności kręgosłupa. W odróżnieniu od klasycznych klatek tytanowych, przezierność radiologiczna PEEK umożliwia dokładną ocenę procesu zrostu międzytrzonowego.
W przypadku klatek kompozytowych możliwe jest wypełnienie ich jamy przeszczepem kostnym, substytutem kości lub materiałem osteokondukcyjnym. Struktura klatki, zaprojektowana metodami inżynierii wspomaganej komputerowo, pozwala uzyskać optymalny rozkład naprężeń na powierzchniach przylegania do trzonów kręgów. Kombinacja kompozytowej obudowy o właściwościach zbliżonych do kości z bioaktywną zawartością sprzyja uzyskaniu stabilnego zrostu, przy jednoczesnym ograniczeniu powikłań wynikających z różnic w sztywności materiałów.
Systemy prętów i śrub kompozytowych wkraczają również do leczenia skolioz oraz innych deformacji kręgosłupa, szczególnie w populacji pediatrycznej, gdzie ważne jest ograniczenie długotrwałej ekspozycji na metal oraz ułatwienie obrazowania kontrolnego. Choć pełne zastąpienie systemów metalowych nie jest obecnie możliwe we wszystkich wskazaniach, rozwój kompozytów o coraz wyższej wytrzymałości zmęczeniowej i lepszej odporności na pełzanie przybliża do tego celu.
Substytuty kości i inżynieria tkanek
Kompozyty bioresorbowalne i bioaktywne znalazły szerokie zastosowanie jako substytuty kości w uzupełnianiu ubytków pourazowych, po resekcjach guzów, w chirurgii szczękowo-twarzowej oraz w stomatologii. Dzięki możliwości kształtowania porowatości, składu fazy ceramicznej i kinetyki degradacji polimeru projektuje się rusztowania, które działają jako tymczasowe matryce dla komórek kościotwórczych.
Takie rusztowania kompozytowe, często w połączeniu z komórkami macierzystymi lub czynnikami wzrostu, stanowią podstawę rozwijającej się inżynierii tkanek. W przyszłości tego typu rozwiązania mogą ograniczyć konieczność stosowania przeszczepów autologicznych, co ma ogromne znaczenie kliniczne: redukuje ryzyko powikłań w miejscu pobrania przeszczepu, skraca czas operacji i zwiększa komfort pacjentów. Przemysł medyczny intensywnie inwestuje w technologie druku 3D kompozytów bioresorbowalnych, co umożliwia tworzenie rusztowań o skomplikowanej geometrii, dopasowanych indywidualnie do ubytków kostnych na podstawie obrazowania tomograficznego.
Wyzwania produkcyjne, regulacyjne i perspektywy rozwoju
Wprowadzenie kompozytów do masowej produkcji implantów ortopedycznych wymaga pokonania szeregu wyzwań technicznych i regulacyjnych. Od właściwego doboru surowców, przez kontrolę procesu wytwarzania, aż po długoterminowe badania kliniczne – każdy etap musi być zaplanowany z uwzględnieniem restrykcyjnych wymagań stawianych wyrobom medycznym wyższych klas ryzyka.
Technologie wytwarzania kompozytów dla ortopedii
W przemyśle medycznym powszechnie stosuje się metody formowania wtryskowego, prasowania na gorąco, nawijania włókien (filament winding), a także nowoczesne technologie addytywne, w tym druk 3D kompozytów na bazie polimerów. Kluczowe znaczenie ma orientacja włókien w strukturze kompozytu: kierunkowe ułożenie zbrojenia pozwala uzyskać wysoką wytrzymałość wzdłuż osi głównych obciążenia, co ma szczególne znaczenie w śrubach, prętach i trzpieniach implantów.
W przypadku kompozytów bioresorbowalnych istotne jest także zachowanie stabilności chemicznej polimeru w trakcie przetwarzania. Zbyt wysoka temperatura lub zbyt długi czas ekspozycji mogą prowadzić do degradacji łańcuchów polimerowych, co zmienia właściwości mechaniczne i profil resorpcji. Dlatego proces musi być starannie walidowany, a każda partia surowca kontrolowana pod kątem masy cząsteczkowej, stopnia krystaliczności i zawartości wilgoci.
Wzrost zainteresowania drukiem 3D kompozytów stawia dodatkowe wyzwania. Uzyskanie jednorodnej struktury przy nakładaniu kolejnych warstw, kontrola porowatości oraz zapewnienie odpowiedniej adhezji międzywarstwowej są kluczowe dla długotrwałej wytrzymałości implantu. Jednocześnie technologia ta otwiera drogę do masowej personalizacji wyrobów, co może stać się jednym z najważniejszych trendów w przyszłości ortopedii.
Zagadnienia regulacyjne i ocena bezpieczeństwa
Kompozytowe implanty ortopedyczne klasyfikowane są jako wyroby medyczne o wysokim ryzyku, co oznacza konieczność przeprowadzenia rozbudowanych badań przedklinicznych i klinicznych. Obejmują one testy mechaniczne (wytrzymałość na ściskanie, rozciąganie, zginanie, zmęczenie), badania biologiczne zgodnie z normami dla oceny biokompatybilności oraz długoterminowe analizy zachowania w warunkach symulujących środowisko organizmu.
Szczególną uwagę poświęca się stabilności materiału w czasie, migracji produktów degradacji oraz możliwym reakcjom immunologicznym. W przypadku kompozytów bioresorbowalnych konieczne jest zrozumienie i opisanie całego cyklu życia implantu w organizmie: od wszczepienia, przez fazę degradacji i przenoszenia obciążeń na odbudowującą się kość, aż po całkowite wchłonięcie materiału. Tego typu analizy wymagają długotrwałych obserwacji klinicznych, często obejmujących wiele lat, zanim implant zostanie szeroko dopuszczony do obrotu.
Regulacje w Unii Europejskiej, w tym rozporządzenie MDR (Medical Device Regulation), nakładają na producentów obowiązek udokumentowania nie tylko bezpieczeństwa, ale i korzyści klinicznych w porównaniu z istniejącymi rozwiązaniami. W przypadku kompozytów oznacza to konieczność wykazania przewagi nad tradycyjnymi implantami metalowymi lub polimerowymi, na przykład w zakresie redukcji powikłań, lepszej integracji z kością czy mniejszej liczby reoperacji. Jednocześnie dynamiczny rozwój technologii kompozytowych wymaga od organów regulacyjnych stałego aktualizowania wytycznych dotyczących badań i oceny ryzyka.
Perspektywy rozwoju: inteligentne i funkcjonalizowane kompozyty
Przyszłość materiałów kompozytowych w ortopedii wiąże się z koncepcją tzw. inteligentnych implantów, które nie tylko stabilizują kość czy zastępują powierzchnie stawowe, ale również reagują na bodźce z otoczenia i dostarczają dodatkowych funkcji. Można tu wyróżnić kilka kierunków rozwoju, które obecnie są przedmiotem intensywnych badań naukowych i rozwojowych.
- Kompozyty z wbudowanymi czujnikami – integracja włókien przewodzących lub mikrosensorów pozwala na monitorowanie obciążeń, postępu zrostu kostnego czy temperatury tkanek w bezpośrednim sąsiedztwie implantu. Dane mogą być przesyłane bezprzewodowo do systemów monitorujących, umożliwiając personalizację rehabilitacji i wczesne wykrywanie powikłań.
- Systemy kontrolowanego uwalniania leków – matryce polimerowe w kompozytach mogą pełnić rolę nośników substancji czynnych, takich jak antybiotyki, leki przeciwbólowe czy czynniki wzrostu. Uwalnianie może być zaprogramowane w czasie lub sterowane bodźcami (np. zmianą pH, temperatury czy pola magnetycznego). Pozwala to na miejscowe leczenie zakażeń, stymulowanie osteogenezy czy zmniejszenie stanu zapalnego bez konieczności podawania wysokich dawek ogólnoustrojowych.
- Funkcjonalizowane powierzchnie kompozytów – modyfikacje chemiczne i topograficzne powierzchni umożliwiają kontrolę adhezji komórek, formowanie biofilmów bakteryjnych czy integrację z tkanką miękką. Na przykład nanostruktury na powierzchni kompozytowego implantu mogą sprzyjać przyczepności osteoblastów, a jednocześnie utrudniać kolonizację przez bakterie, co zmniejsza ryzyko zakażeń okołoprotezowych.
Wraz z rozwojem metod obliczeniowych i symulacyjnych rośnie także znaczenie wirtualnego projektowania kompozytów. Analiza numeryczna pozwala przewidywać zachowanie złożonych struktur podczas wieloletniej eksploatacji i w różnych scenariuszach obciążenia. Umożliwia to optymalizację składu oraz architektury kompozytu jeszcze przed etapem kosztownych badań laboratoryjnych i klinicznych.
Dalszy rozwój materiałów kompozytowych w ortopedii będzie ściśle związany z postępem w dziedzinie biologii komórki, nanotechnologii oraz analizy danych. Połączenie dogłębnego zrozumienia procesów biologicznych zachodzących w tkankach z możliwościami inżynierii materiałowej otwiera drogę do tworzenia implantów coraz bardziej zindywidualizowanych i funkcjonalnych. W konsekwencji rola kompozytów w przemyśle medycznym będzie systematycznie rosnąć, zmieniając standardy leczenia urazów i schorzeń układu ruchu.